Na co se přípravek Zontivity - vorapaxar používá a k čemu se používá?
Zontivita je léčivý přípravek užívaný ke snížení výskytu aterotrombotických příhod (problémů způsobených krevními sraženinami a zahuštěním tepen), včetně nových infarktů myokardu nebo mrtvice u dospělých pacientů s anamnézou infarktu myokardu. Podává se současně s aspirinem a případně s třetím lékem, klopidogrelem; tyto dva léky také pomáhají předcházet aterotrombotickým příhodám. Zontivita obsahuje účinnou látku vorapaxar .
Jak se používá Zontivita - vorapaxar?
Zontivita je dostupná ve formě tablet (2 mg) a lze ji získat pouze na lékařský předpis. Doporučená dávka je jedna tableta jednou denně. Léčba Zontivitou by měla být zahájena nejméně 2 týdny po infarktu myokardu, nejlépe během prvních 12 měsíců po události. Údaje o používání Zontivity po dobu delší než 2 roky jsou omezené; proto po 2 letech léčby musí být přínos a rizika Zontivity u jednotlivých pacientů přehodnocena ošetřujícím lékařem.
Jak Zontivity - vorapaxar působí?
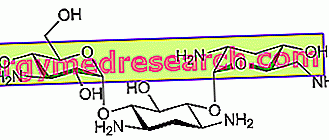
Účinná látka přípravku Zontivity, vorapaxar, je inhibitorem agregace krevních destiček. To znamená, že pomáhá zabránit tvorbě krevních sraženin. Koaguluje krev, když se určité krevní buňky, nazývané krevní destičky, navzájem spojí. Vorapaxar blokuje receptory PAR-1 (známé jako „receptory trombinu“) na povrchu destiček. Trombin je jednou z látek, které přispívají ke koagulačnímu procesu: navázáním na receptor PAR-1 dělá destičky „viskózní“ a tímto způsobem podporuje tvorbu sraženin. Blokováním receptoru PAR-1 tento přípravek zabraňuje tomu, aby se destičky staly viskózní, což snižuje riziko tvorby sraženin a pomáhá předcházet mrtvici nebo novému infarktu myokardu.
Jaký přínos přípravku Zontivity - vorapaxar byl prokázán v průběhu studií?
Zontivita byla porovnána s placebem (léčbou neúčinným přípravkem) v hlavní studii zahrnující více než 26 000 dospělých s anamnézou infarktu myokardu nebo jiných aterotrombotických příhod. Téměř všichni pacienti také užívali aspirin a / nebo jiný lék k prevenci aterotrombotických příhod a byli léčeni nejméně jeden rok. Hlavním měřítkem účinnosti byl počet pacientů, kteří hlásili „událost“ včetně nového infarktu myokardu nebo cévní mozkové příhody nebo kteří zemřeli na kardiovaskulární onemocnění (problémy postihující srdce a krevní cévy). Zontivita byla při snižování výskytu aterotrombotických příhod účinnější než placebo. Aterotrombotická příhoda byla pozorována u 9, 5% pacientů (1 259 z 13 225 subjektů), kteří užívali Zontivitu ve srovnání s 10, 7% (1 417 z 13 224 subjektů) pacientů léčených placebem. Přínos Zontivity byl výraznější u podskupiny 16 897 pacientů s anamnézou infarktu myokardu, kteří však nikdy neměli mrtvici nebo přechodný ischemický záchvat (tzv. „Miniinfarkt“). V této skupině byla pozorována aterotrombotická příhoda u 8, 5% pacientů (719 z 8 458 pacientů), kteří užívali Zontivitu ve srovnání s 10, 3% (867 z 8 439 pacientů) pacientů léčených placebem.
Jaká rizika jsou spojena s přípravkem Zontivity - vorapaxar?
Nejběžnějším vedlejším účinkem Zontivity (který může postihnout až 1 z 10 lidí) je krvácení, zejména krvácení z nosu (krvácení z nosu). Úplný seznam vedlejších účinků hlášených v souvislosti s přípravkem Zontivity je uveden v příbalových informacích. Zontivita by neměla být podávána pacientům, kteří měli mrtvici nebo mini infarkt myokardu. Přípravek nesmí užívat také pacienti, kteří měli intrakraniální krvácení (krvácení do mozku) nebo aktivní krvácení nebo pacienti s těžkým poškozením funkce jater. Zontivita by neměla být podávána v kombinaci s prasugrelem nebo tikagrelorem, dalšími dvěma léky, které pomáhají předcházet agregaci krevních destiček. Úplný seznam omezení naleznete v příbalové informaci.
Proč byl přípravek Zontivity - vorapaxar schválen?
Výbor agentury pro humánní léčivé přípravky (CHMP) agentury rozhodl, že přínosy přípravku Zontivity převyšují jeho rizika, a doporučil, aby byl přípravek schválen pro použití v EU. Bylo prokázáno, že léčivo je prospěšné při snižování počtu aterotrombotických příhod u pacientů, kteří měli infarkt myokardu. Pokud jde o bezpečnostní profil Zontivity, výbor CHMP vyjádřil znepokojení nad rizikem krvácení u pacientů užívajících přípravek Zontivity vedle standardní léčby, zejména rizika závažného krvácení, které je častější u pacientů s cévní mozkovou příhodou v anamnéze.
Považoval proto za vhodné omezit jeho použití na pacienty, kteří ještě nikdy neměli mrtvici.
Jaká opatření jsou přijata k zajištění bezpečného a účinného používání Zontivity - vorapaxar?
Byl vypracován plán řízení rizik, aby bylo zajištěno, že Zontivita bude používána co nejbezpečněji. Na základě tohoto plánu byly do souhrnu údajů o přípravku a příbalové informace pro přípravek Zontivity zahrnuty informace o bezpečnosti, včetně příslušných opatření, která musí zdravotníci a pacienti dodržovat. Další informace jsou k dispozici v souhrnu plánu řízení rizik.
Více informací o Zontivity - vorapaxar
Dne 19. ledna 2015 vydala Evropská komise rozhodnutí o registraci přípravku Zontivity platné v celé Evropské unii. Úplné znění zprávy EPAR a souhrnu plánu řízení rizika zontivity naleznete na internetových stránkách agentury: ema.Europa.eu/Find lékařství / Lidské léky / Evropské veřejné hodnotící zprávy. Další informace o léčbě přípravkem Zontivity naleznete v příbalové informaci (rovněž součástí zprávy EPAR) nebo kontaktujte svého lékaře či lékárníka. Poslední aktualizace tohoto souhrnu: 01-2015.