Trypsin a chymotrypsin jsou dva klíčové enzymy při trávení proteinů v potravě. Oba jsou produkovány a vylučovány jako zymogeny, tj. V neaktivní formě, slinivkou břišní; prekurzor zymogenu trypsinu se nazývá trypsinogen, zatímco chymotrypsin se nazývá chymotrypsinogen.
Trypsin a chymotrypsin patří do velké rodiny proteolytických enzymů (zapojených do štěpení proteinů) a do podskupiny endopeptidázy. Tyto látky - včetně žaludečního pepsinu a pankreatické elastázy - napadají peptidové vazby uvnitř aminokyselinového řetězce, což vede ke vzniku menších molekulárních fragmentů. Enzymy patřící do druhé skupiny, tj. Exopeptidáz, dokončí práci trypsinu a chymotrypsinu, oddělují jednotlivé aminokyseliny od konců peptidového řetězce; Pankreatické karboxypeptidázy (A1, A2 a B, které napadají karboxylový konec) patří do této rodiny, ale také aminopeptidázy (které napadají aminoterminální konec) a dipeptidázy, které jsou produkovány a vylučovány sliznicí tenkého střeva. Některé karboxypeptidázy, podobné těm, které byly pozorovány pro trypsin (trypsinogen) a chymotrypsin (chymotrypsinogen), jsou vylučovány slinivkou břišní v neaktivní formě. Ve všech třech případech je enzymem zapojeným do procesu enzymatické aktivace enteropeptidáza, protein produkovaný a vylučovaný buňkami duodenální sliznice; specifičtěji, enteropeptidáza je specifická pro trypsinogen, který jednou přeměněný na trypsin také aktivuje další proteolytické enzymy, včetně samotného trypsinogenu.
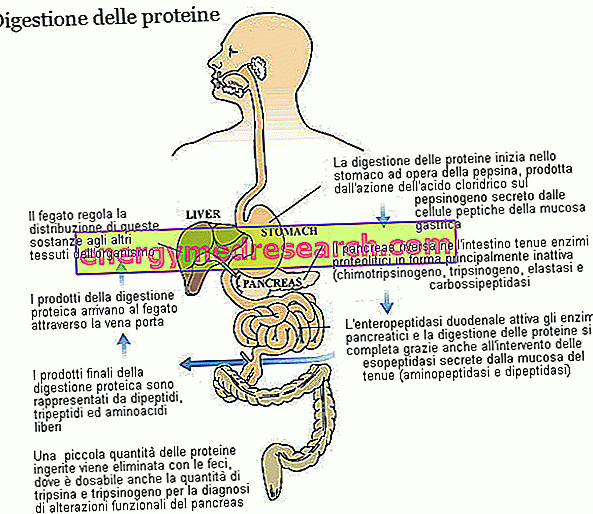
Funkční rozdíly mezi trypsinem a chymotrypsinem se týkají pouze jejich specifičnosti, tj. Schopnosti rozpoznávat a štěpit pouze vazby tvořené dobře definovanými aminokyselinami. Trypsin zasahuje hlavně do peptidových vazeb, které se zabývají bazickými aminokyselinami (jako je arginin a lysin), zatímco chymotrypsin hydrolyzuje hlavně vazby zahrnující tyrosin, fenylalanin, tryptofan, leucin a methionin.
Díky různým proteolytickým enzymům, s přispěním žaludeční kyselosti, jsou dietní proteiny - původně tvořené několika desítkami aminokyselin - rozděleny na dipeptidy, tripeptidy a volné aminokyseliny, všechny snadno vstřebatelné látky, které z kapilár střevní sliznice přicházejí transportovány do jater.
Trypsin a chymotrypsin ve stolici
Používá se stanovení chymotrypsinu a trypsinu ve stolici, a to zejména v minulosti, jako nepřímý test funkční kapacity exokrinního pankreatu. Pokud něco nefunguje správně na této úrovni žlázy, je logické očekávat sníženou syntézu trypsinu a chymotrypsinu, která bude také nedostatečná ve stolici. Test má dobrou citlivost, ale je zatížen skutečným rizikem falešných pozitiv a falešných negativ. Použití laxativ například snižuje koncentraci enzymů ve výkalech, zatímco příjem extraktů trávicího pankreatu (např. Pankreatinu) nebo zeleniny (např. Ananasový stonek, papája, papain a způsobuje falešně negativní výsledky. Také střevní bakteriální flóra mírně ovlivňuje množství trypsinu a chymotrypsinu, které se dostávají do stolice nezměněné; z tohoto důvodu může použití antibiotik vést k falešným negativům; naopak, v přítomnosti divertikulózy a jiných stavů, které podporují proliferaci bakterií, mohou být zaznamenány falešně pozitivní výsledky.
Klasickou aplikací dávek trypsinu a chymotrypsinu ve stolici je detekce pankreatické insuficience u pacientů s cystickou fibrózou. Jedním z důsledků tohoto onemocnění je zhoršení normálního transportu trypsinu a jiných trávicích enzymů z pankreatu do dvanáctníku; z tohoto důvodu jsou při narození výkaly dítěte s cystickou fibrózou zvláště kompaktní až do té míry, že způsobují střevní obstrukci. V důsledku toho se v meconii zaznamenávají zvláště malá množství chymotrypsinu a trypsinu.