Na co se přípravek Stayveer - Bosentan používá a na co se používá?
Stayveer je léčivý přípravek, který obsahuje léčivou látku bosentan . Je indikován k léčbě pacientů s plicní arteriální hypertenzí (PAH) ve třídě III za účelem zlepšení zátěžové kapacity a symptomů. PAH je patologický stav, ve kterém je tlak v plicních tepnách vysoký. "Třída" označuje závažnost nemoci: "třída III" zahrnuje silné omezení fyzické aktivity. PAH může být:
- primární (bez jakékoli identifikované nebo rodinné příčiny);
- způsobené sklerodermií (nebo progresivní systémovou sklerózou, stav charakterizovaný abnormálním růstem pojivové tkáně podporující kůži a další orgány);
- způsobené vrozenými srdečními vadami (přítomnými od narození) s zkraty (malformace dýchacích cest), které způsobují abnormální průtok krve mezi srdcem a plícemi.
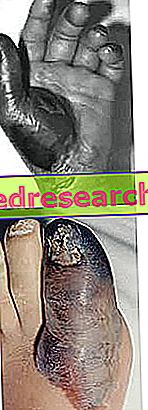
- Zlepšení byla také pozorována u pacientů s třídou PAH II. "Třída II" zahrnuje mírné omezení fyzické aktivity. Přípravek Stayveer lze také použít u dospělých pacientů s progresivní systémovou sklerózou, u nichž špatný krevní oběh způsobený tímto onemocněním způsobil výskyt „vředů na prstech“ (zánět prstů na rukou a nohou). Cílem společnosti Stayveer je snížit počet nových vředů.
Tento přípravek je stejný jako přípravek Tracleer, který je již registrován v Evropské unii (EU). Společnost, která přípravek Tracleer vyrábí, souhlasila s tím, že její vědecké údaje mohou být použity pro přípravek Stayveer („informovaný souhlas“).
Jak se přípravek Stayveer - Bosentan používá?
Přípravek Stayveer lze získat pouze na lékařský předpis a léčbu by měl zahájit a sledovat lékař, který má zkušenosti s léčbou PAH nebo progresivní systémovou sklerózou. Přípravek Stayveer je dostupný ve formě tablet (62, 5 mg a 125 mg), které musí být spolknuty vodou. Tablety se užívají ráno a večer. U dospělých je počáteční dávka 62, 5 mg dvakrát denně po dobu čtyř týdnů, následně se zvyšuje na obvyklou dávku 125 mg dvakrát denně. U dětí s PAH by měla být používaná dávka vypočtena na základě tělesné hmotnosti a obvykle začíná 2 mg na kilogram dvakrát denně. Další informace naleznete v příbalové informaci. Lékař vyhodnotí odpověď pacienta na přípravek Stayveer a po 8 týdnech u pacientů s PAH, kteří neuvedli zlepšení, stejně jako pravidelně u pacientů s progresivní systémovou sklerózou s pokračujícími vředy na digitálních snímcích, vyhodnotí potřebu pokračovat v další léčbě. Pokud se lékař rozhodne ukončit léčbu přípravkem Stayveer, měla by být dávka postupně snižována. Pacienti léčení přípravkem Stayveer musí dostat zvláštní memorandum shrnující hlavní informace o bezpečnosti přípravku.
Jak přípravek Stayveer - Bosentan působí?
Účinná látka přípravku Stayveer, bosentan, inhibuje přirozeně se vyskytující hormon nazývaný endothelin-1 (ET-1), který způsobuje zúžení krevních cév. Proto Stayveer určuje expanzi cév. PAH je oslabující onemocnění, při kterém dochází k výraznému zúžení krevních cév v plicích. To způsobuje velmi vysoký krevní tlak v cévách, které přenášejí krev z pravé strany srdce do plic. Tento tlak snižuje množství kyslíku, který může krev přenášet do plic, což ztěžuje fyzickou aktivitu. Dilatací těchto krevních cév se krevní tlak snižuje a symptomy se zlepšují. U pacientů s progresivní systémovou sklerózou a probíhajícími vředy na břiše zlepšuje bosentan krevní oběh prstů na prstech prstů na nohou a prstech, čímž zabraňuje vzniku nových vředů.
Jaký přínos přípravku Stayveer - Bosentan byl prokázán v průběhu studií?
U přípravku PAH byl přípravek Stayveer zkoumán ve čtyřech hlavních studiích: dvě studie, do kterých bylo zařazeno celkem 245 dospělých pacientů s PAH ve třídě III nebo IV, primárně nebo zapříčiněných sklerodermií, studie provedená na 54 dospělých pacientech s PAH ve třídě III spojených s vrozené srdeční vady, stejně jako studie 185 pacientů s PAH ve třídě II. Studie porovnávaly přípravek Stayveer s placebem (látka bez účinku na organismus), obě přidané ke standardní terapii. Hlavním měřítkem účinnosti byla vzdálenost, kterou pacienti mohli projít za šest minut (způsob měření zátěžové kapacity); studie na onemocnění II. třídy však také zkoumala změnu odporu v průtoku krve v plicních cévách (indikátor zúžení cév). U PAH třídy III nebo IV, primární nebo způsobené sklerodermií, tyto dvě studie ukázaly, že pacienti léčení přípravkem Stayveer byli schopni pokrýt delší vzdálenosti než pacienti léčení placebem po 16 týdnech léčby (o 44 metrů více ve studii). větší velikost); počet pacientů s PAH ve IV. třídě však byl příliš malý na to, aby podpořil užívání tohoto přípravku v této skupině. Podobné výsledky se objevily iu pacientů s vrozenými srdečními vadami. U pacientů s PAH třídy II indukoval přípravek Stayveer po šesti měsících léčby snížení rezistence krevních cév o 23% ve srovnání s placebem, ale pacienti v odstupu mohli chodit za šest minut, což bylo podobné u obou skupin. Studie byla také provedena na 19 dětech a dospívajících ve věku od 3 do 15 let, ve kterých bylo pozorováno zlepšení parametrů souvisejících se srdcem a tepnami. V případě progresivní systémové sklerózy s digitálními vředy, dvě studie srovnávaly přípravek Stayveer s placebem u celkem 312 dospělých. Hlavní míra účinnosti byla založena na počtu nových vředů, které se vyvinuly během studií. Jedna ze studií také zkoumala účinky přípravku Stayveer na zotavení 190 pacientů, přičemž měřila dobu potřebnou k dosažení úplného hojení daného vředu u každého pacienta. Přípravek Stayveer byl účinnější než placebo při snižování tvorby nových vředů. V první studii uvedli pacienti užívající přípravek Stayveer průměrně 1, 4 nových vředů po 16 týdnech ve srovnání s 2, 7 vředy u pacientů léčených placebem. Podobné výsledky byly pozorovány ve druhé studii po 24 týdnech léčby, avšak přípravek Stayveer neměl žádný vliv na hojení vředů na prstech.
Jaká rizika jsou spojena s přípravkem Stayveer - Bosentan?
U PAH jsou nejčastějšími vedlejšími účinky přípravku Stayveer (které mohou postihnout více než 1 z 10 osob) bolesti hlavy a abnormální testy jaterních funkcí. U pacientů s digitálními vředy jsou nejčastějšími vedlejšími účinky přípravku Stayveer (které mohou postihnout více než 1 z 10 osob) abnormální testy jaterních funkcí, otoky a retence tekutin. Vzhledem k riziku vzniku problémů s játry Vám lékař před léčbou a každý měsíc během léčby přípravkem Stayveer změří hladiny jaterních enzymů. Úplný seznam vedlejších účinků hlášených v souvislosti s přípravkem Stayveer je uveden v příbalových informacích. Přípravek Stayveer by neměly užívat pacienti, kteří mají problémy s játry, těhotné ženy nebo ženy ve fertilním věku, které nepoužívají spolehlivé antikoncepční metody nebo pacienty léčené cyklosporinem A (léčivo působící na imunitní systém). Úplný seznam omezení naleznete v příbalové informaci.
Na základě čeho byl přípravek Stayveer - Bosentan schválen?
Výbor agentury pro humánní léčivé přípravky (CHMP) agentury rozhodl, že přínosy přípravku Stayveer převyšují jeho rizika, a doporučil, aby byl přípravek schválen pro použití v EU.
Jaká opatření jsou přijata k zajištění bezpečného a účinného užívání přípravku Stayveer - Bosentan?
Byl vypracován plán řízení rizik, aby bylo zajištěno, že je Stayveer používán co nejbezpečněji. Na základě tohoto plánu byly do souhrnu údajů o přípravku a příbalové informace pro přípravek Stayveer zahrnuty informace o bezpečnosti, včetně příslušných opatření, která musí dodržovat zdravotníci a pacienti. Kromě toho společnost, která přípravek Stayveer vyrábí, poskytne informační sadu pro předepisující lékaře a informační leták pro pacienty v každém členském státě, aby vysvětlila bezpečnost přípravku Stayveer (se zvláštním ohledem na jeho účinky na játra a během těhotenství) a \ t jeho interakcí. Společnost se rovněž zavazuje, že bude pečlivě sledovat distribuci léčiva v každém členském státě a shromažďovat informace o jeho použití u pacientů s progresivní systémovou sklerózou s probíhajícími vředy.
Další informace o produktu Stayveer - Bosentan
Dne 24. června 2013 Evropská komise udělila rozhodnutí o registraci přípravku Stayveer platné v celé Evropské unii. Další informace o léčbě přípravkem Stayveer naleznete v příbalové informaci (rovněž součástí zprávy EPAR) nebo kontaktujte svého lékaře či lékárníka. Poslední aktualizace tohoto souhrnu: 06-2013.